实用免疫学(七)适应性免疫:体液免疫
环境中的病原体侵入生物机体后,胞外菌寄居在宿主的细胞外组织液、淋巴液和血液等体液中。侵入的病原体会刺激特异性B细胞活化并分化为浆细胞。根据B细胞对Ag的反应,将Ag分为TI-Ag(胸腺非依赖性抗原)和TD-Ag(胸腺依赖性抗原)。活化的B细胞通过产生抗体来发挥效应。
TI-Ag
该类抗原刺激机体产生抗体无需T细胞的辅助,可以分为TI-1Ag和TI-2Ag。
TI-1Ag
既有抗原表位又有丝裂原性质
丝裂原性质:无需APC提呈即可非特异性刺激多克隆T、B细胞发生有丝分裂,属于非特异的淋巴细胞多克隆激活剂
具有B细胞多克隆激活作用,如细菌LPS等,成熟或未成熟B细胞均可对其产生应答
婴儿和新生动物B细胞发育不成熟,不能对TI-2Ag产生应答,但仍能对TI-1AG产生应答
高浓度经B细胞膜上的丝裂原受体(如TLR4)识别,非特异性地诱导多克隆B细胞增殖和分化
低浓度需经BCR识别而特异性地诱导B细胞增殖和分化
多克隆增殖:刺激机体多个B细胞克隆
TI-2Ag
其表面含多个重复B细胞表位,如肺炎链球菌荚膜多糖、聚合鞭毛素等
仅能刺激成熟的B细胞,且不能引起B细胞的多克隆增殖
诱导抗原特异性的成熟B细胞BCR交联反应而产生B细胞的活化
也可通过结合补体分子C3d、C3dg等激活补体旁路MBL途径
TI抗原一般激活的主要是CD5+B1细胞,所产生的主要为低亲和力的IgM抗体。由于无特异性T细胞辅助,TI抗原一般不能诱导Ig类别转换、抗体亲和力成熟和记忆B细胞产生
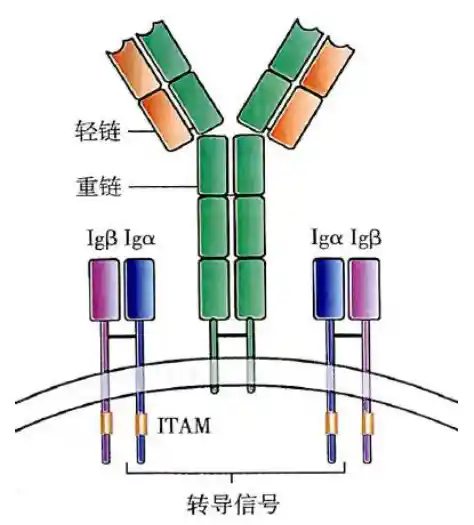
BCR复合体图示
- BCR复合物:由mIg(膜表面免疫球蛋白)和Igα/β(CD79a/b)异二聚体两部分组成
- 不同发育阶段的mIg不同:成熟的B细胞为IgM和IgD;浆细胞不再表达
- mIg胞质区只有3AA,不能高效传递抗原刺激信号,因此需要靠胞质区长且有ITAM的Igα/β异二聚体来传递抗原激活信号,同时后者的跨膜区极性AA能与BCR的跨膜区的TAST和YSTTVT中的极性AA(T、S)形成盐键来稳定BCR结构
- Igα/β异二聚体胞外区借二硫键连接。ITAM主要通过酪氨酸磷酸化募集下游信号分子。
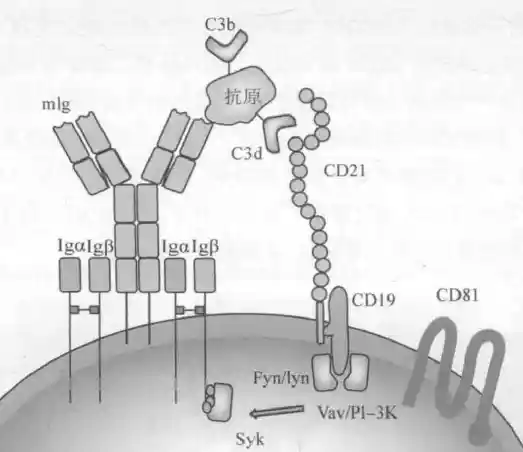
BCR交联激活流程
多个重复B细胞表位的TI-2Ag聚集多个BCR复合体,同时TI-2Ag结合C3d聚集CD21-CD19,形成BCR-Ag-Cd3dg-CD21-CD19。CD19募集Fyn/Lyn,聚集的Src家族(受体相关性蛋白酪氨酸激酶)彼此成簇而发生相互磷酸化,同时使CD79CD19的ITAM磷酸化,进一步导致SyK酪氨酸激酶活化(与TCR下游ZAP-70类似),接着通过活化PLC-γ和EGF,使B细胞增殖分化
B细胞活化共受体复合物:能促进BCR对抗原的识别和B细胞活化的受体
CD19:除将细胞外各B细胞谱系均有,受体酪氨酸激酶,通过pY(酪氨酸磷酸化)募集Src PTK家族成员的LYN等信号分子。
CD21:主要表达于成熟B细胞,II型补体受体(CR2,C3d受体)和EB病毒受体(感染后持续增殖转化);能特异性结合C3d,自身发生pY,进一步活化CD79上的ITAM,为招募PI3K提供结合位点,同时定位PI3K到共辅助受体分子上;能结合CD23,促进B细胞分裂增殖
CD81:促进B细胞增殖
TD-Ag
TD抗原主要为蛋白质抗原,如病原微生物、血细胞、血清蛋白。BCR首先特异性结合抗原,产生B细胞活化的第一信号,B细胞内化BCR所结合的抗原,并对抗原进行加工,形成抗原肽-MHCII类分子复合物(pMHC)呈递给抗原特异性Th识别,Th活化后通过表达的CD40L与B细胞表面的CD40结合,又提供B细胞活化的第二信号。同时活化的T细胞分泌的细胞因子诱导B细胞进一步活化,分化为浆细胞。
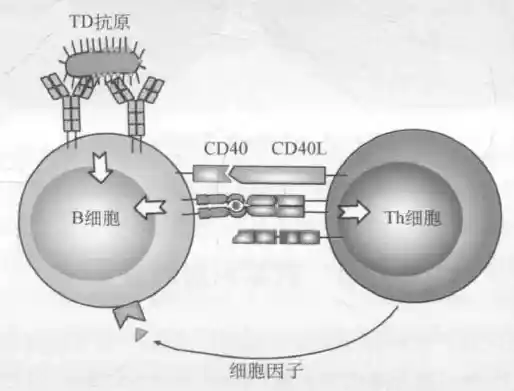
B细胞对TD抗原的识别
成熟的初始B细胞定居淋巴滤泡:成熟的初始B细胞高表达趋化因子受体CXCR5,其配体CXCL13由分布在淋巴滤泡的基质细胞和滤泡树突细胞分泌。定居滤泡的初始B细胞大部分会在淋巴细胞再循环中遭遇抗原,如果几个月没有接触抗原则会发生凋亡
TD-Ag的获取与识别:血源性抗原进入脾脏,组织中的抗原进入淋巴结,被补体共价修饰后,能同时结合BCR和共受体复合物。小的可溶性抗原能够在淋巴液中循环,经管道进入淋巴滤泡,被滤泡中的B细胞识别。较大的复杂抗原,可以形成免疫复合物或与补体片段共价结合,被巨噬细胞和树突细胞表面的补体受体和FcγR捕获,持续表达在表面,供B细胞识别
与抗原接触2~4分钟后,B细胞的细胞膜会发生扩张,存在于细胞膜上的BCR会进行重新排列与聚集,更好地与抗原结合,为信号传递及B细胞的再次活化做准备;识别BCR后,B细胞在保持CXCR5表达的同时上调CCR7受体
同时在T细胞区,初始T细胞通过识别DC表面的MHC分子呈递的抗原肽而被活化,上调表达CD40L;下调CCR7并上调CXCR5Th细胞与第一次活化的B细胞双向奔赴:CCR7的配体趋化因子是在T细胞区的CCL19和CCL21,CXCR5的配体趋化因子是在滤泡的CXCL13。因此活化的B细胞向T细胞区与滤泡区的交界处迁移,活化的T细胞向滤泡区移动
接触抗原的B细胞2小时后会内吞抗原,处理加工产生的抗原肽段经MHCII类分子呈递,表达在B细胞的表面。在交界区与活化的Th细胞相遇将抗原呈递给Th细胞,同时表达B7与T细胞表面的CD28结合而提供Th活化的第二信号,同时接受活化Th细胞表面的CD40L和分泌的细胞因子(IL2、IL4、IL21、IL6、IFNγ;活化的巨噬细胞也会分泌IL1、IL7共同作用),被充分活化。
同时部分激活的Th细胞开始表达CXCR5,进入淋巴滤泡,分化为Tfh。
充分活化的B细胞分两部分,一部分不再表达CXCR5,转为表达EB12和CXCR4,迁移到滤泡外区域,如淋巴结髓索,在4天内增殖分裂并分化为早期浆细胞,形成原发灶,产生少量以IgM为主的抗体,参与早期防御,可出现抗体类别转换。另一部分下调CCR7,表达CXCR5和CXCR4,进入淋巴滤泡,继续增殖分裂,形成生发中心,在Tfh细胞的帮助下,经历B细胞的抗体基因可变区高频率点突变和抗原选择的抗体亲和力成熟,以及抗体类别转化,在6~10天内,最终产生高亲和力抗体的浆细胞和记忆B细胞。高亲和力抗体的浆细胞迁移至骨髓。
浆细胞:除少量线粒体外,多粗糙型内质网,表面Ig表达水平接近0,多迁往骨髓、不分泌细胞因子
记忆B细胞:来源于生发中心,部分留在淋巴滤泡、大部分进入血液循环,再次遇到同一抗原刺激时,能在记忆性Th细胞协助下活化,表面标记分子CD19、CD27,表达特异性BCR
生发中心
内层暗区的生发中心母细胞产生生发中心细胞,向外移动形成明区。明区中含有较多的FDC和Tfh细胞、巨噬细胞,大量竞争不到抗原刺激信号和T细胞辅助的B细胞会发生凋亡然后被巨噬细胞吞噬清除生发中心母细胞:每6~8小时分裂一次的B细胞,低表达mIg
生发中心细胞:体积较小,重新高表达mIg的B细胞
AID介导B细胞的抗体基因突变
抗原和CD40L刺激信号激活诱导B细胞的AID,介导B细胞在暗区发生SHM,后B细胞在明区接受阳性选择,由于SHM的随机性,拥有高亲和力的BCR的B更能从FDC竞争获得抗原,得以优势扩增。同时BCR激活也能通过Akt通路和PI3K一直凋亡蛋白产生,促进P53降解,进一步保证高亲和力BCRB细胞的增殖
体细胞高频突变SHM:在基因重排的基础上,成熟B细胞在外周淋巴器官生发中心接受抗原刺激后在编码CDR部位的基因序列发生点突变,以增加抗体多样性
抗体类别转换
Ig重链基因大约200kb,μ、δ、γ、ε和α重链C基因位于重排后的VDJ基因的下游。mIgM、mIgD来源于同一mRNA的可变剪切,而其他三类Ig的表达需要Ig重链恒定区基因发生断裂后重排,从连接Cμ转换为连接Cγ、Cα、Cε基因,进而产生抗体的类别转换为IgG、IgA、IgE。因为Ig重链的V区保持不变,因此类别转换不涉及抗体抗原结合特异性。
AID首先攻击抗体重链S区WGCW/WCGW碱基对中的C,使其脱氨形成U,然后机体通过BER和MMR等修复机制形成DSB(DNA双链断裂),然后通过非同源重组的方式连接,从而形成抗体基因的类别转换。
当没有成功进行非同源末端连接时,DNA重新结合可能使用微同源末端结合。除μ和δ能同时表达外,B细胞只会表达其中一种抗体类别
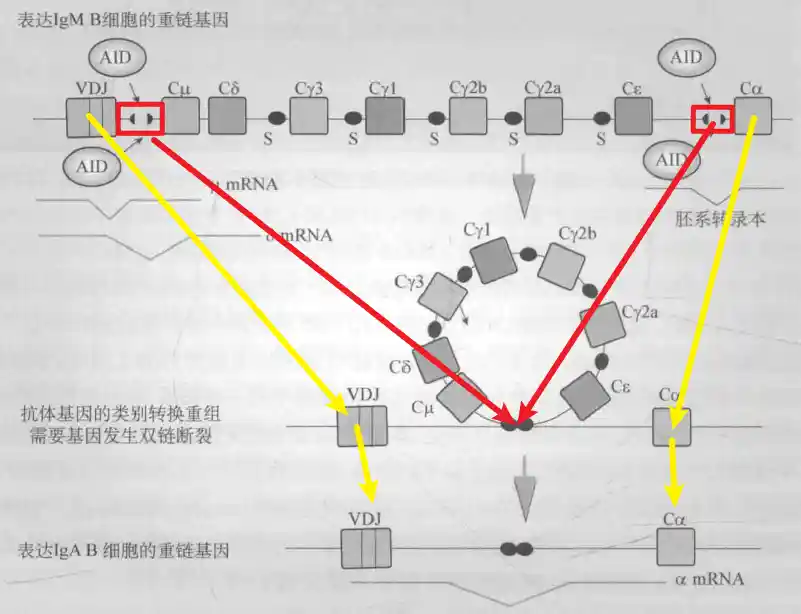
抗体的结构和功能
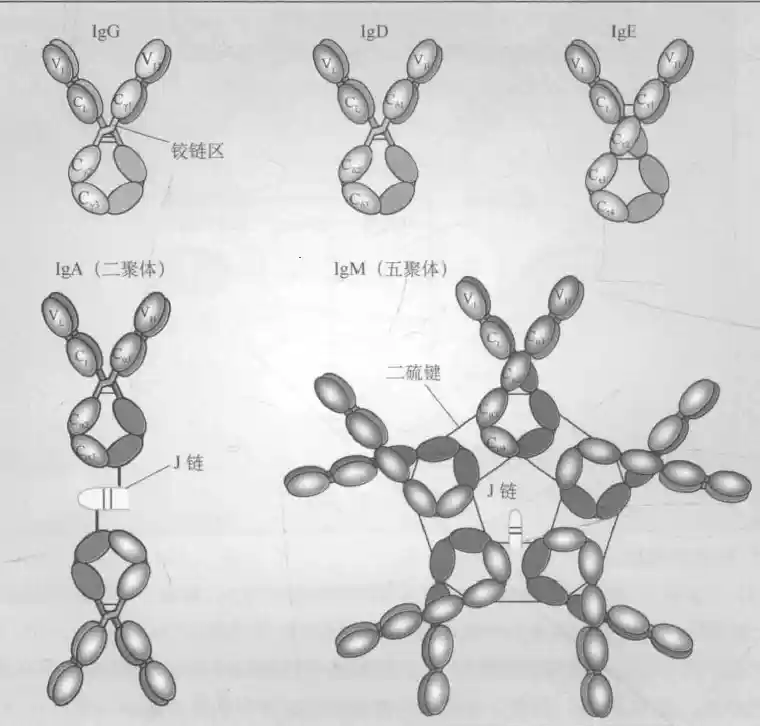
Ig基因的类别转换受到抗原以及Th细胞等分泌的细胞因子调节
IgM
在胚胎后期开始合成
可分为单体型mIgM(未成熟B细胞标志)和分泌型五聚体,C区4个结构域,需要J链辅助
IgM与抗原形成复合物,激活补体经典途径和旁路途径
IgM在初次免疫应答最早出现,具有早期诊断价值,若脐带血中IgM含量升高,则提示宫内感染,也是天然血型抗体
C区:H/L链靠近C端的氨基酸组成和排列相对恒定的区域,占H的3/4、L的1/2
依据CH的差异分五类,IgM是其中无亚型的一类,长度与结构域数量有关
依据CL的差异可以分κ型和λ型,其中λ链C区个别氨基酸差异可以分λ1~4,长度基本一致,人κ:λ=2:1J链:将其连接为聚体
IgD
随时能够合成,半衰期相当短
可分为血清型和膜结合型mIgD(成熟B细胞标志),C区3个结构域
只有重复多价的抗原才能触发IgD的信号,IgD可结合并激活嗜碱性粒细胞和肥大细胞,继而使其产生抗微生物的因子以参与气道的免疫防御,结合IgD的嗜碱性粒细胞还可以释放B细胞稳态因子,维持B细胞的数量。
IgD的结构灵活多变,在IgM缺陷时可以替代IgM的功能。
IgG
出生后三个月开始合成,3-5岁接近成年人水平,半衰期最长
其在血清中含量最高,可以分1234中亚类,C区3个结构域
IL-4刺激IgG1、IFNγ刺激IgG2a、TGFβ刺激IgG2b、IFNγ刺激IgG3、IL10刺激IgG4
除IgG2外,唯IgG可通过胎盘屏障(胎盘母体一侧的滋养层细胞表达一种IgG输送蛋白FcRn,IgG可以选择性地与FcRn结合,从而转移到滋养层细胞内,并主动进入胎儿血液循环中),同时也存在母乳中起自然被动免疫作用
是再次免疫的主要抗体,IgG312激活补体的经典途径、参与调理作用和ADCC;IgG4激活补体旁路途径
介导II、III型超敏反应
IgG能够在特定抗原与亲细胞的IgE结合介导过敏反应之前将抗原拦截。因此,IgG能够阻止少量抗原诱发全身性的过敏反应
IgA
出生后4~6个月开始合成
分血清型和分泌型(二聚体),有1、2亚类,C区3个结构域,需要J链和SP辅助
TGFβ和IL5刺激抗体类别转换成IgA
SP:分泌片/分泌成分,由黏膜上皮细胞合成
结合于IgA二聚体上,形成分泌性sIgA,保护铰链区免受蛋白酶降解,同时介导IgA转运至黏膜表面(和pIgR相关)参与黏膜免疫,和边缘区的抗感染,存在于母乳中,IgA1激活补体旁路途径,参与调理作用和ADCC
IgE
出现较晚,在血清中含量最低,对热不稳定
C区有4个结构域,具有亲细胞性
能激活补体旁路途径,与肥大细胞和嗜酸性细胞表面FcεRI结合介导I型超敏反应
主要参与抗寄生虫感染